A etapa de alongamento, o segundo passo do processo de síntese de proteína, requerem proteínas específicas que não são tão ribossomas e EEFs FE. O alongamento polipeptídeo ocorre de uma forma cíclica de tal modo que a extremidade de um ciclo completo de adição de ácido amino sítio A está vazia e pronta para aceitar a entrada de aminoacil -tRNA ditada pelo codão seguinte do mRNA.
Isto significa que não só o ácido amino de entrada a ser ligado à cadeia peptídica, mas o ribossoma deve passar o mRNA para o codão seguinte. Cada entrada aminoacil tRNA - ao ribossoma é transportada por um complexo de EPS- 1α -GTP.
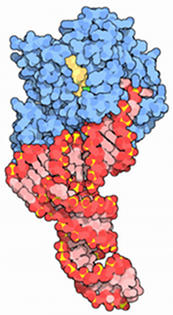
Quando o ARNt correcto é depositado no local do GTP é hidrolisada e se dissocia EPS- 1α - PIB complexos. Para eventos de translocação adicionais, o PIB deve ser trocado por GTP. Isto é conseguido através EEF- 1βγ de forma semelhante ao que ocorre com a troca de GTP catalisada pelo FEI -2 eIF -2B.
O péptido ligado ao tRNA no sítio P é transferido para o grupo amino no aminoacil- tRNA no sítio A. Esta reacção é catalisada por peptidiltranserasa. Este processo é chamado de transpeptidação. O peptídeo alongado, agora reside em um tRNA no sítio A. Um site deve ser livre para aceitar o próximo aminoacil- tRNA. O processo de movimentação do local de peptidil -tRNA no local P é chamado, a translocação.
Translocação é catalisada pela EEF -2 gene, juntamente com a hidrólise de GTP. No processo de translocação dos movimentos ao longo do mRNA ao ribossoma de modo a que a posição de codão seguinte do mRNA é A. sítio Após a translocação, a EEF gene libera o ribossomo e o ciclo pode começar de novo.
A capacidade do gene EEF -2 para realizar a translocação é regulada pelo estado de fosforilação da enzima. Quando a enzima é inibida de fosforilação. Fosforilação EEF -2 gene é catalisada pela enzima quinase eEF2 ( eEF2K ). A regulamentação da atividade de enzima é normalmente baixa eEF2K controle insulina fluxos e Ca2 +. Os efeitos provocados pelo Ca2 +são o resultado da interacção entre a calmodulina com o eEF2K enzima. A activação do enzima eEF2K no músculo esquelético pelo Ca2 +é importante para reduzir o consumo de ATP no processo de síntese de proteínas durante períodos de exercício, que conduz à libertação de Ca2 +armazenado. O eEF2K acima também regulada por fosforilação e quinase que fosforila a enzima é regulada pela proteína quinase mTOR. Além disso, a proteína cinase reguladora professor metabólica da proteína quinase ativada por AMP ( AMPK ), são as enzimas fosforila e activa eEF2K levando à inibição EEF -2 gene.
Artigos relacionados com Fase de alongamento da síntese da proteína
 |  |  |
| Proteína total | Proteínas e aminoácidos | Dieta da proteína |